Cribado PGT-M y PGT-A para reducir el riesgo de transmisión de enfermedades genéticas
 Las tecnologías de cribado genético como el PGT-M (antes conocido como DGP) y el PGT-A (antes conocido como PGS), cuando se combinan con el tratamiento de FIV, han hecho posible reducir el riesgo de transmisión de enfermedades genéticas devastadoras, disminuir posiblemente la probabilidad de abortos recurrentes y mejorar las probabilidades de éxito del embarazo.
Las tecnologías de cribado genético como el PGT-M (antes conocido como DGP) y el PGT-A (antes conocido como PGS), cuando se combinan con el tratamiento de FIV, han hecho posible reducir el riesgo de transmisión de enfermedades genéticas devastadoras, disminuir posiblemente la probabilidad de abortos recurrentes y mejorar las probabilidades de éxito del embarazo.Al igual que con todas las tecnologías de reproducción asistida, es importante entender para qué situaciones es mejor utilizar la tecnología, los posibles riesgos, los costes y qué esperar durante el tratamiento.
Aunque tanto el PGT-M como el PGT-A son tecnologías de cribado genético que se utilizan con la FIV, difieren en el motivo y el modo en que se utilizan.
¿Qué significa PGT-M?PGT-M significa "prueba genética preimplantacional para trastornos monogénicos". PGT-M se utiliza cuando es necesario identificar una enfermedad genética específica en el embrión. Puede desearse evitar la transmisión de una enfermedad genética o utilizarse para elegir una tendencia genética muy específica.
¿Qué diferencias hay entre los tratamientos de DGP y PGT?
Enfermedades de transmisión sexual que afectan a la fertilidad y al embarazo
A veces, ambas cosas son necesarias; por ejemplo, cuando una pareja quiere concebir un hijo que pueda ser compatible con un trasplante de células madre para un hermano, pero también quiere evitar la transmisión del gen que causa la enfermedad que requiere el trasplante de células madre.
El PGT-M no analiza un solo embrión para detectar todas las posibles enfermedades genéticas. Por ejemplo, si un embrión no parece tener el gen de la fibrosis quística (FQ), eso no le dice si hay otras enfermedades genéticas. Sólo le da la seguridad de que la FQ es muy poco probable.
¿Qué significa PGT-A?PGT-A significa "prueba genética de preimplantación para la aneuploidía". PGT-A no busca genes específicos, sino la composición cromosómica general del embrión.
En general, los embriones pueden clasificarse como euploides o aneuploides. En una situación normal, el óvulo aporta 23 cromosomas y el esperma otros 23. Juntos, crean un embrión sano con 46 cromosomas. Esto se denomina embrión euploide.
Sin embargo, si un embrión tiene un cromosoma de más -o le falta un cromosoma- se denomina aneuploidía. Los embriones con aneuploidía tienen más probabilidades de no implantarse o de acabar en aborto. Si se produce la implantación, el embarazo y el nacimiento, los embriones aneuploides pueden dar lugar a un niño con discapacidades mentales o físicas.
Por ejemplo, el síndrome de Down puede ocurrir cuando hay una copia extra del cromosoma 21. El PGT-A puede identificarlo antes de que el embrión se transfiera al útero.
El PGT-A también puede identificar el sexo de un embrión. El cribado cromosómico completo (CCS) es una técnica de la PGT-A que puede identificar si un embrión es XX (femenino) o XY (masculino). Esto puede utilizarse para evitar un trastorno genético ligado al sexo o (más raramente) para el equilibrio familiar.
PGT-M y PGT-A frente a las pruebas prenatalesTanto la PGT-M como la PGT-A tienen lugar durante la preimplantación, antes de que el embrión se haya implantado en el útero. A diferencia de las pruebas prenatales, en las que la implantación ya se ha producido. Las pruebas prenatales sólo pueden realizarse si se ha establecido un embarazo.
Las que deciden continuar con el embarazo se enfrentan a la incertidumbre y el miedo a lo que les espera al nacer. Además de la preocupación por tener un hijo con discapacidades de por vida, pueden enfrentarse a un mayor riesgo de que nazca muerto. Las que deciden interrumpir el embarazo se enfrentan al dolor, posiblemente a la culpa, y al dolor físico y la recuperación del aborto.
Algunas personas tienen objeciones religiosas o éticas a la interrupción del embarazo, pero se sienten cómodas con las pruebas genéticas antes de la transferencia de embriones. Dicho esto, la PGT-M y la PGT-A no están garantizadas. La mayoría de los médicos recomiendan hacer pruebas prenatales además de las pruebas genéticas de preimplantación, por si acaso un diagnóstico genético fuera erróneo o se pasara por alto.
Razones para realizar la prueba de un diagnóstico genético específico con la FIV Acontinuación se indican las posibles razones por las que su médico puede recomendar la PGT (o las razones por las que usted puede solicitarla).
Enfermedades genéticas heredadas
Este es el motivo más común de la PGT. Dependiendo de si una enfermedad genética es autosómica dominante o recesiva, el riesgo de transmitir un trastorno genético a un hijo puede ser de entre el 25% y el 50%.
En algunos casos, puede que una pareja no necesite la FIV para quedarse embarazada y no se enfrente a la infertilidad. Su única razón para recurrir a la FIV puede ser la realización de pruebas genéticas preimplantatorias.
Como se ha mencionado anteriormente, las pruebas prenatales también pueden detectar enfermedades genéticas, sin el gasto, los riesgos y los costes añadidos del tratamiento de FIV. Pero como la única opción es la interrupción del embarazo (o la continuación del mismo) después de la prueba prenatal, esto es inaceptable para algunas parejas.
Enfermedades genéticas comúnmente probadas
La siguiente lista es de Johns Hopkins Medicine:
- Fibrosis quística
- Distrofia muscular de Duchenne
- Hemofilia A
- Enfermedad renal poliquística
- Anemia de células falciformes
- Enfermedad de Tay-Sachs
- Talasemia
Translocación
Algunas personas nacen con los 46 cromosomas, pero una sección de un cromosoma se rompe y se vuelve a unir a otro cromosoma. Esto se denomina translocación.
Las personas con una translocación pueden estar sanas, pero su riesgo de sufrir infertilidad, de que un embarazo acabe en aborto o en muerte fetal, o de tener un hijo con una anomalía cromosómica es mayor que la media.
En el caso de las parejas que tienen un compañero con una translocación, el PGT puede utilizarse para ayudar a identificar los embriones que tienen más probabilidades de ser sanos.
Correspondencia HLA
El trasplante de células madre es la única cura para ciertas enfermedades de la sangre. Encontrar un donante compatible dentro de la familia no siempre es fácil. Sin embargo, el PGT-M puede utilizarse para elegir un embrión que sea compatible con las células madre (antígeno leucocitario humano, o HLA) y, posiblemente, evitar la transmisión de esa misma enfermedad genética a un hermano.
Si se puede identificar un embrión con compatibilidad HLA y se produce un nacimiento sano, las células madre necesarias para salvar la vida del hermano pueden extraerse de la sangre del cordón umbilical al nacer.
Predisposición genética a la enfermedad de inicio en la edad adulta
Aunque es más controvertido, el DGP se utiliza a veces para evitar la transmisión de tendencias genéticas que pueden dar lugar a enfermedades más adelante en la vida. Por ejemplo, aunque tener una variante perjudicial del gen BRCA1 o BRCA2 no significa que una persona vaya a desarrollar cáncer de mama, su riesgo de padecer esta enfermedad será mayor.
El DGP puede utilizarse para examinar los embriones en busca de variantes genéticas perjudiciales y seleccionar los que no presentan dichas variantes para su implantación.
El Comité de Ética de la Sociedad Americana de Medicina Reproductiva (ASRM) afirma: "El DGP para las afecciones de inicio en la edad adulta está éticamente justificado cuando la afección es grave y no se dispone de intervenciones seguras y eficaces. Está éticamente permitido para condiciones de menor gravedad o penetrancia".
Razones para el cribado genético general con la FIV Heaquí algunas razones comunes por las que se puede utilizar el PGT-A con el tratamiento de la FIV.
Mejora de las probabilidades de éxito con la transferencia electiva de un solo embrión
Varios estudios han descubierto que el cribado preimplantacional puede ayudar a mejorar las probabilidades de embarazo y reducir el riesgo de aborto cuando se opta por la transferencia electiva de un solo embrión.
Con la transferencia electiva de un solo embrión o eSET, su médico transfiere un solo embrión de aspecto saludable durante el tratamiento de FIV. Esto es en lugar de transferir dos embriones a la vez, una técnica que aumenta las probabilidades de éxito pero que también conlleva el riesgo de concebir múltiples. Los embarazos múltiples conllevan riesgos para la salud de la madre y del bebé.
Sin el PGT-A, el embrión se elige tradicionalmente en función de su aspecto. Sin embargo, se ha descubierto que los embriones que no parecen perfectos al microscopio pueden estar sanos. Y los embriones que parecen sanos pueden no ser tan cromosómicamente normales como parecen. La PGT-A elimina algunas de las conjeturas.
Identificación del sexo
Normalmente se utiliza cuando una enfermedad genética está basada en el género, el PGT-A puede ayudar a identificar si un embrión es femenino o masculino. Esta puede ser una forma ligeramente menos costosa que la PGT-M de evitar una enfermedad genética.
Sin embargo, el PGT-A también puede utilizarse para ayudar a una pareja a tener un hijo de un sexo concreto cuando esperan "equilibrar" su familia. En otras palabras, ya tienen un niño y ahora quieren una niña o viceversa. Esto rara vez se haría si la pareja no necesitara la FIV por otro motivo.
El Colegio Americano de Obstetras y Ginecólogos (ACOG) está éticamente en contra de utilizar el PGS para la selección de sexo sin una razón médica.
Reducir el riesgo de aborto
El aborto espontáneo es frecuente, y se produce hasta en el 25% de los embarazos. El aborto espontáneo recurrente -tener tres o más pérdidas seguidas- no lo es. El PGT-A puede utilizarse para ayudar a reducir las probabilidades de sufrir otro aborto espontáneo.
La investigación sobre si el PGT-A puede mejorar realmente las probabilidades de embarazo de las mujeres con un historial de pérdidas repetidas de embarazo no está clara. Mientras que algunos estudios han mostrado mejores probabilidades con la PGT-A, otros no han mostrado ninguna diferencia. Hable con su médico para determinar la mejor opción para usted.
El riesgo de sufrir un aborto espontáneo puede ser menor, pero es posible que el embarazo y el parto no se produzcan antes. Actualmente, la ASRM no recomienda la FIV con PGT-A en los casos de aborto espontáneo recurrente.
Mejora de las probabilidades de éxito de la FIV
Algunos médicos especialistas en fertilidad recomiendan la PGT-A junto con la FIV para aumentar las probabilidades de éxito del tratamiento en los casos de infertilidad por factor masculino grave, en las parejas que han experimentado repetidos fallos de implantación en la FIV o en las mujeres de edad materna avanzada.
Actualmente hay pocos estudios que demuestren que la PGT-A mejora el éxito del tratamiento de FIV cuando no está indicada específicamente. Muchos de los estudios que han hallado tasas de éxito más elevadas analizan las tasas de nacidos vivos por transferencia de embriones, y no por ciclo.
Siempre será mayor que las tasas por ciclo, porque no todos los ciclos de FIV dan lugar a embriones para transferir. La investigación aún no ha demostrado si existe una verdadera ventaja.
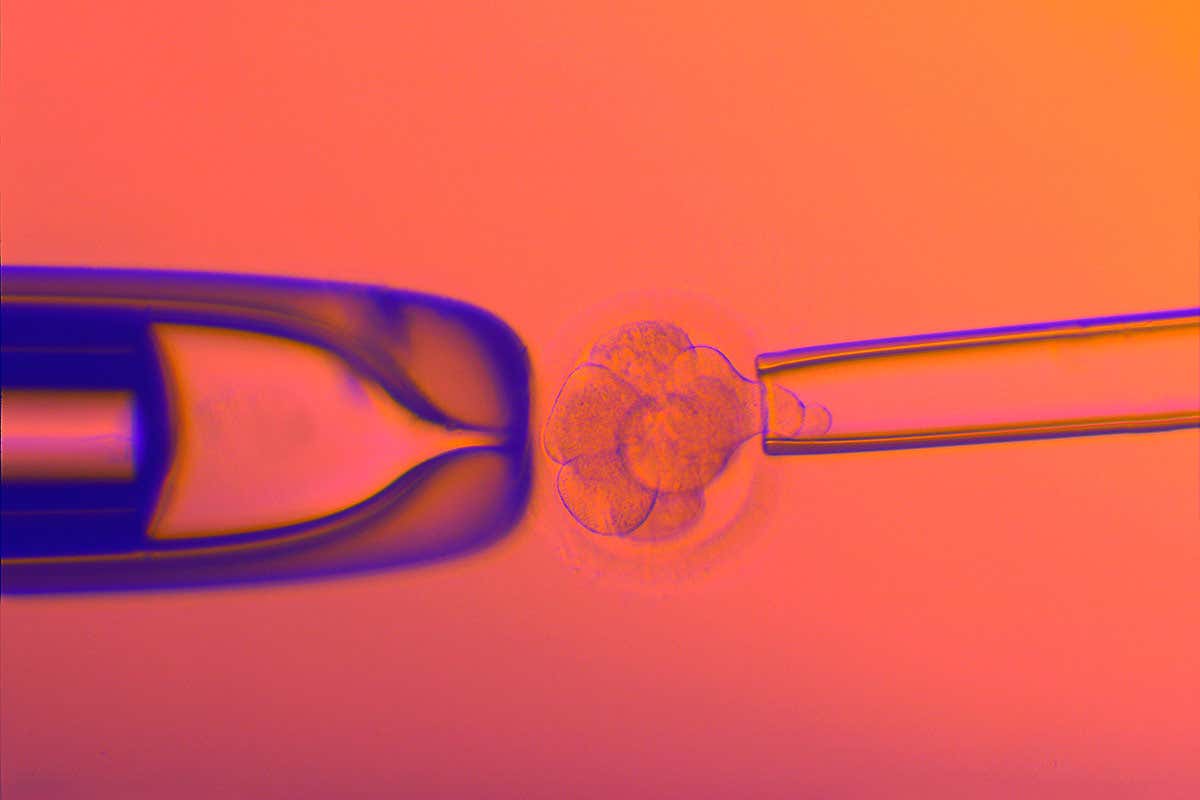
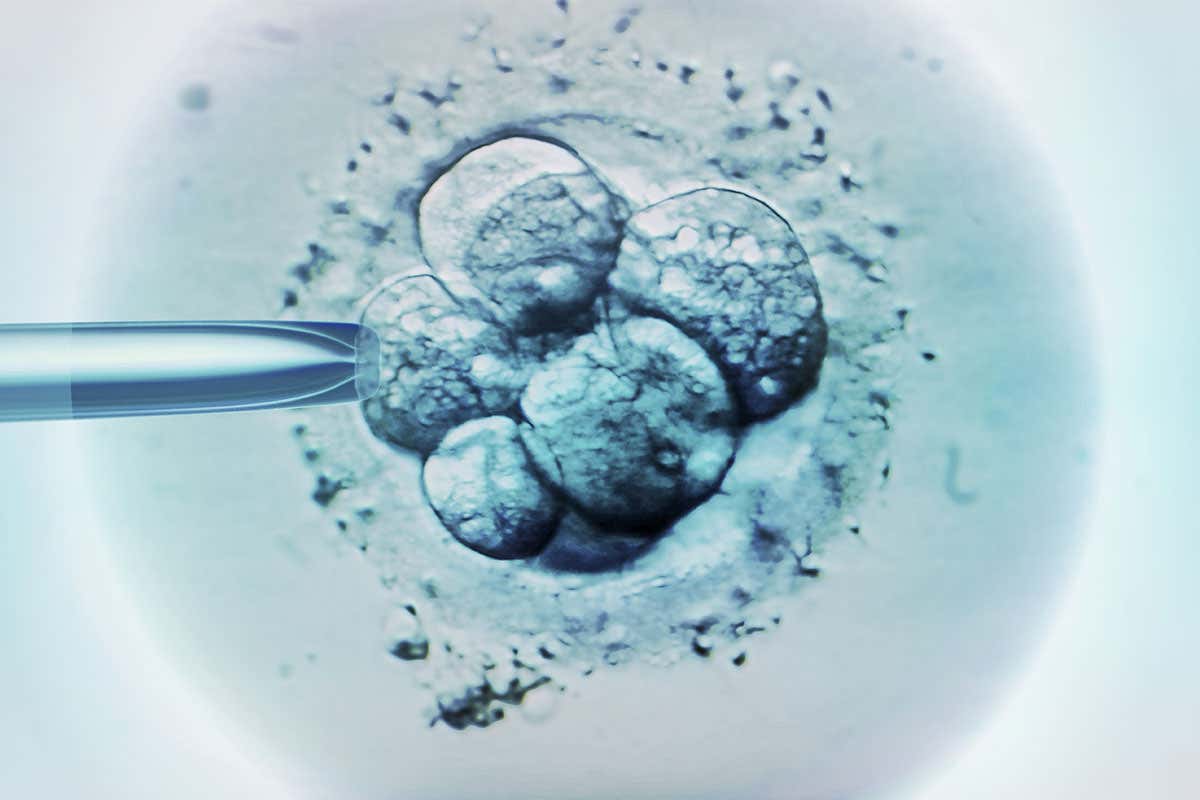
¿Cómo se hacen las biopsias de los embriones?Para realizar cualquier prueba genética, hay que hacer una biopsia de las células del embrión. La zona pelúcida es una capa protectora que envuelve al embrión. Esta capa protectora debe romperse para poder realizar la biopsia de algunas células. Para romperla, un embriólogo puede utilizar un láser, un ácido o una aguja de vidrio.
Una vez que se ha hecho una pequeña abertura, se extraen las células que se van a analizar, bien con succión a través de una pipeta, o bien se aprieta suavemente el embrión hasta que salen algunas células por la abertura rota.
La biopsia del embrión puede realizarse tres días después de la fecundación o cinco días. Cada una de ellas tiene sus pros y sus contras.
Biopsia del embrión del día 3: Un embrión del día 3 se conoce como blastómero. Sólo tiene entre seis y nueve células. Es posible hacer el cribado genético de una sola célula, pero es mejor tomar dos.
Una de las mayores ventajas de realizar una biopsia en el Día 3 es que las pruebas pueden realizarse a tiempo para una transferencia de embriones frescos en el Día 5 después de la extracción de óvulos. Esto significa menos tiempo de espera y un menor coste (ya que es posible que no tenga que pagar por una transferencia de embriones congelados).
Sin embargo, algunas investigaciones han descubierto que la biopsia de más de una célula en esta fase aumenta el riesgo de "detención del embrión". El embrión puede dejar de desarrollarse y ya no puede ser transferido. Esto es poco frecuente, pero sigue siendo un riesgo a tener en cuenta. Además, el riesgo de falsos positivos y resultados inclusivos es mayor con la biopsia del día 3.
Biopsia de embrión de día 5: Un embrión de día 5 se denomina blastocisto. En esta fase, el embrión tiene cientos de células. Algunas de estas células se convertirán en el feto, otras en la placenta. El embriólogo puede tomar más células para analizarlas -normalmente entre el día 5 y el 7-, lo que puede permitir un mejor diagnóstico y menos resultados no concluyentes.
Las células extraídas son las destinadas a convertirse en placenta; las células fetales se dejan intactas. Una desventaja de la biopsia del día 5 es que no todos los embriones sobreviven en el entorno del laboratorio durante tantos días, incluso los que están sanos.
Además, la biopsia del Día 5 requiere que los embriones se criopreserven hasta que se obtengan los resultados. Esto significa que la persona tendrá que esperar al menos hasta el mes siguiente para realizar la transferencia de embriones. Será un ciclo de transferencia de embriones congelados, lo que supone un tiempo de espera y unos costes adicionales. También existe el riesgo de que los embriones no sobrevivan a la congelación y descongelación.
Sin embargo, después de este proceso sólo suelen quedar los embriones más fuertes. Los que sobreviven y tienen buenos resultados tienen aún más probabilidades de dar lugar a un resultado saludable.
¿Cuál es el proceso de FIV con PGT-M y PGT-A?Existen algunas diferencias en el modo en que se realizan los ciclos de tratamiento de FIV para las pruebas PGT-M o PGT-A.
Con el PGT-M, el proceso puede comenzar meses antes del tratamiento de FIV propiamente dicho. Dependiendo del diagnóstico genético específico que se necesite, puede ser necesario realizar pruebas genéticas a los miembros de la familia. Esto es necesario para crear una sonda genética, que es como un mapa utilizado para señalar exactamente dónde se encuentra la anomalía o el marcador genético.
La PGT-A no requiere la realización de pruebas genéticas a los miembros de la familia y sólo implica la realización de pruebas a los embriones. Durante el ciclo de FIV propiamente dicho, la experiencia del paciente con cada tipo de prueba es similar, aunque la tecnología genética en el laboratorio sea diferente.
La diferencia entre la FIV con cribado genético y el tratamiento convencional está en la fase embrionaria. Normalmente, tras la fecundación, los embriones sanos se consideran para la transferencia tres o cinco días después de la extracción de los óvulos. Con el PGT-M o el PGT-A, se realiza una biopsia de los embriones el día 3 (tras la extracción de los óvulos) o el día 5. A continuación, las células se envían para su análisis. Si los embriones se analizan el día 3, los resultados pueden llegar antes del día 5. Si es así, los embriones con buenos resultados pueden considerarse para la transferencia. Los embriones sobrantes pueden criopreservarse para otro ciclo.
Sin embargo, puede recomendarse o preferirse la biopsia del Día 5. En este caso, se realiza una biopsia de los embriones y se criopreserva inmediatamente. En este caso no se transferirán embriones durante el ciclo de FIV. En su lugar, permanecerán "en hielo" hasta que lleguen los resultados de las pruebas genéticas.
Una vez que se disponga de los resultados, suponiendo que algún embrión se considere transferible, la madre tomará medicamentos para suprimir la ovulación y preparar el útero para la implantación. En el momento adecuado, se descongelarán uno o varios embriones y se prepararán para la transferencia.
Cuando se elige un ciclo de biopsia de día 5 y transferencia de embriones congelados, el tiempo de tratamiento puede abarcar de dos a cuatro meses (con un posible mes de descanso/espera).
Riesgos del PGT-M y del PGT-ALa FIV con pruebas genéticas de preimplantación conlleva todos los riesgos del tratamiento de FIV convencional.
Además de estos, cualquier persona que se plantee la posibilidad de acogerse a la PGT-M/PGT-A debe comprender también estos riesgos adicionales:
- Las tasas de nacimientos vivos pueden ser inferiores a las de los compañeros de la misma edad. Esto se debe a que algunos embriones no sobreviven al proceso y algunos (o todos) pueden dar malos resultados.
- Con la biopsia del día 5, hay un riesgo ligeramente mayor de gemelaridad idéntica.
- Son posibles los falsos positivos y los falsos negativos. En otras palabras, los embriones que son anormales pueden resultar "normales", y los embriones sanos pueden ser diagnosticados erróneamente como anormales y descartados.
- Si todos los embriones obtienen malos resultados, es posible que no haya ninguno para transferir.
- Pueden producirse resultados no concluyentes. También conocidos como embriones en mosaico, es cuando algunas células parecen cromosómicamente normales y otras no. Algunos estudios publicados en 2017 han descubierto que los embriones en mosaico pueden corregirse por sí mismos y dar lugar a un embarazo y un bebé sanos.
- La criopreservación y la posterior descongelación pueden provocar la pérdida de embriones que, por lo demás, están sanos.
- Algunos embriones, por lo demás sanos, pueden no sobrevivir hasta el día 5 después de la extracción de los óvulos.
- La biopsia de embriones del día 3 puede provocar una parada embrionaria, en la que el embrión deja de desarrollarse.
- La PGT-M/PGT-A no es infalible, y puede producirse un niño con una enfermedad o trastorno genético. Se recomienda la realización de pruebas prenatales además de la PGT-M/PGT-A para obtener más garantías.
- Unas buenas pruebas prenatales y de preimplantación no garantizan que el niño no se vea afectado por discapacidades físicas o mentales de otro tipo.
- El riesgo de aborto espontáneo puede ser menor con los embriones PGS normales, pero sigue habiendo cierto riesgo de pérdida del embarazo.
- Esperar los resultados y tener que tomar decisiones sobre los embriones con resultados no concluyentes puede ser emocionalmente difícil.
- La tecnología es tan nueva que no sabemos con certeza cuál puede ser el efecto a largo plazo en los niños nacidos tras una FIV con PGT-M/PGT-A. Sin embargo, los resultados parecen buenos según un artículo publicado en 2019.
La FIV ya es cara. Añadir el coste de la PGT-M o la PGT-A eleva aún más ese precio. De media, las pruebas genéticas de preimplantación añaden entre 3.000 y 7.000 dólares al tratamiento de FIV. El coste de un ciclo de FIV con PGT-M/PGT-A puede ser de entre 17.000 y 25.000 dólares.
Además, es posible que tengas que pagar un ciclo de transferencia de embriones congelados (FET). Esto supondrá entre 3.000 y 5.000 dólares más. A veces, los pacientes quieren planificar el ciclo de FET inmediatamente después del ciclo de FIV. De este modo, en cuanto los resultados del cribado genético estén disponibles, podrán transferir los embriones normales sin tener que esperar un mes más.
Sin embargo, un posible problema de este enfoque es que si no hay embriones normales para transferir, se habrá desperdiciado parte de los costes del FET. Todos los fármacos de fertilidad que se hayan tomado para suprimir la ovulación y preparar el útero para la implantación se habrán tomado sin motivo.
Esperar un mes más puede ser emocionalmente difícil, pero puede tener más sentido desde el punto de vista económico. Con el PGT-M, es posible que tenga gastos más allá del propio tratamiento de fertilidad. El PGT-M a veces requiere pruebas genéticas de los miembros de la familia, y esos costes no estarán incluidos en el presupuesto de su clínica de fertilidad y pueden no estar cubiertos por el seguro.
El cribado genético ha ayudado a las familias con una enfermedad genética o translocaciones cromosómicas a tener más posibilidades de tener un hijo sano y evitar la transmisión de enfermedades devastadoras. El cribado genético también ha ayudado a los médicos a mejorar la selección de embriones en los ciclos electivos de transferencia de un solo embrión.
No está claro si la PGT-M/PGT-A puede mejorar realmente las tasas de nacidos vivos más allá de estas situaciones. La tecnología es todavía bastante nueva y está en constante evolución. El uso de PGT-A para mejorar las tasas de nacidos vivos en la FIV cuando la tecnología no está específicamente indicada es controvertido.
Algunos médicos afirman que el éxito ha mejorado, mientras que otros se preguntan si realmente merece la pena el coste y los riesgos adicionales. Algunos piensan que debería ofrecerse a todas las pacientes de FIV; otros creen que debería ofrecerse raramente, en casos muy específicos.
Es posible que la PGT-A ayude a evitar la transferencia de embriones que inevitablemente habría acabado en aborto. Sin embargo, esto no significa que la pareja no hubiera tenido finalmente un resultado de embarazo saludable con posteriores transferencias de embriones congelados (FET) del mismo ciclo.
Por ejemplo, supongamos que una pareja obtiene tres embriones fuertes. Supongamos que hacen el PGT-A y descubren que dos de los embriones son normales. Se transfieren uno o dos, y digamos que el embarazo se produce en uno o dos ciclos. Ahora, supongamos que esa misma pareja decide no hacer el PGT-A y resulta que transfiere primero el embrión con la anomalía cromosómica. Ese ciclo acabará en aborto. Pero todavía tienen uno o dos embriones más a la espera de ser descongelados y transferidos y es probable que obtengan un bebé sano de uno de esos embriones. (En una situación de máxima probabilidad, por supuesto).
Según un estudio publicado en 2016, la investigación dice que las probabilidades de nacer vivo son similares en cada situación, con y sin PGT-A. Pero hay un coste emocional por experimentar un aborto espontáneo. El PGT-A no elimina las probabilidades de pérdida, aunque parece reducir ese riesgo.
Sólo usted y su médico pueden decidir si la FIV con PGT-M/PGT-A es adecuada para su familia. Antes de decidirse, asegúrese de comprender por qué su médico le recomienda esta tecnología de reproducción asistida, los costes totales (incluidos los ciclos de criopreservación y FET) y los posibles riesgos.