Se descubre que los testículos son un reservorio viral para la replicación del SARS-CoV-2
En un estudio reciente publicado en el servidor de preimpresión medRxiv*, los investigadores utilizaron un conjunto de métodos para detectar el coronavirus del síndrome respiratorio agudo severo 2 (SARS-CoV-2) en los testículos de los pacientes que murieron por la enfermedad del coronavirus 2019 (COVID-19) para obtener información sobre el tropismo del SARS-CoV-2 dentro de los testículos y su impacto en la fertilidad masculina.
Las células testiculares humanas expresan receptores de la enzima convertidora de angiotensina 2 (ACE2), que median la entrada del SARS-CoV-2 en las células del huésped. Varios estudios han sugerido que los hombres se ven más afectados por la infección por el SRAS-CoV-2 que las mujeres; por tanto, es crucial estudiar el tropismo del SRAS-CoV-2 en los testículos y evaluar el impacto de la infección por el SRAS-CoV-2 en la fertilidad masculina.
Aunque estudios anteriores han demostrado alteraciones testiculares promovidas por la infección por el SARS-CoV-2, sigue sin estar clara la patogénesis testicular en profundidad, incluyendo las alteraciones celulares, enzimáticas, hormonales y genéticas críticas en los testículos de los pacientes con COVID-19.
Sobre el estudioLos científicos realizan un meta-análisis del impacto del SARS-CoV-2 en los parámetros del esperma
Los órganos reproductores femeninos no son susceptibles a la infección directa por el SARS-CoV-2
En el presente estudio, los investigadores recogieron los testículos de 11 pacientes varones no vacunados que fallecieron por complicaciones de COVID-19. Recogieron los testículos mediante una incisión en el rafe medio del escroto en las tres horas siguientes a la muerte del paciente. Incidieron en fragmentos de parénquima testicular y los almacenaron en una solución de RNAlater® para realizar posteriormente estudios genéticos virales y testiculares.
Para evaluar la replicación viral y los niveles de testosterona y angiotensina, se tomaron muestras de los testículos y se congelaron en nitrógeno líquido. Asimismo, para los análisis histológicos, de microscopía electrónica de transmisión (TEM) y de inmunohistoquímica, las muestras de testículos se incrustaron en metacrilato, resina Epon 812 y Paraplast® F.
Los autores analizaron las muestras recogidas para detectar la presencia del ARN viral del SRAS-CoV-2 mediante una reacción en cadena de la polimerasa con transcriptasa inversa cuantitativa (RT-qPCR) con cebadores para amplificar el gen de la envoltura (E). Las muestras que mostraron un umbral de ciclo (TC) ≤ 40 se consideraron infectadas por el SARS-CoV-2.
El grupo de control estaba formado por seis pacientes que se sometieron a una orquiectomía por sospecha de cáncer de próstata, y sus testículos se recogieron y utilizaron para realizar análisis TEM, histológicos, hormonales y moleculares. La edad media de los pacientes de los grupos de prueba y de control era de 63,9 ± 13,11 años y 58 años, respectivamente. Ninguno de los pacientes tenía antecedentes clínicos de trastornos testiculares previos.
Resultados del estudio
La RT-qPCR reveló la presencia del ARN del SARS-CoV-2 en los testículos de 10 de los 11 pacientes. Un sensor de diseño nanométrico que utiliza la resonancia de plasmón de superficie localizada (LSPR) también detectó la proteína de espiga (S) del SARS-CoV-2 en los testículos de 10 de los 11 pacientes. Se observó una inmunomarcación prominente de la proteína S en los testículos de todos los pacientes de COVID-19, lo que sugiere que el tropismo del SARS-CoV-2 por los testículos era mayor de lo que se había evaluado anteriormente, ya que el protocolo convencional de RT-qPCR sólo detectaba testículos infectados con una mayor carga viral. Los autores recomendaron el desarrollo de técnicas sensibles con una mayor sensibilidad de detección para la detección fiable del SARS-CoV-2 (incluso en un título viral bajo) en los testículos.
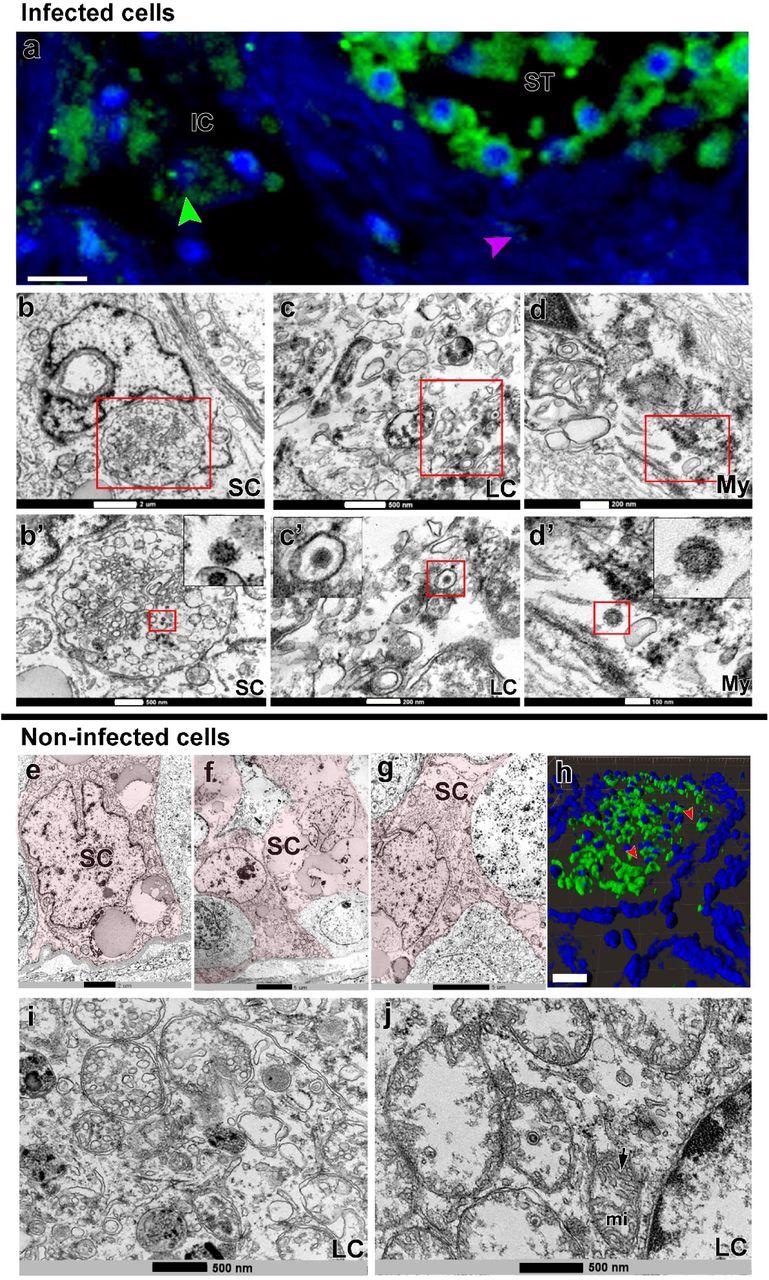
Infección por el SARS-CoV-2 en las células de Sertoli, Leydig y mioides peritubulares. a) Inmunofluorescencia contra la proteína S que evidencia un marcado débil en las células mioides peritubulares (punta de flecha rosa) y en las células de Leydig (punta de flecha verde) (Barra de escala =15µm). b-d') Imágenes TEM mostrando partículas virales (en bajo y alto aumento) en la célula de Sertoli (SC) (Barras de escala = b: 2µm; b': 500nm); célula de Leydig (LC) (Barras de escala = c 500nm; c': 200nm y célula mioide peritubular (My) (Barras de escala = d: 200nm; d': 100nm). e-g) Imágenes TEM de células de Sertoli no infectadas (SC, rosa) (Barras de escala = e: 2µm f-g: 5µ). h) Reconstrucción en 3D de un corte transversal de un túbulo seminífero que muestra las zonas no marcadas que rodean a las células germinales (puntas de flecha rojas) (barra de escala = 40µm). i-j) Gran aumento de células de Leydig no infectadas. Flecha = cresta tubular de una mitocondria (mi) (barras de escala = 500nm). Imágenes de inmunofluorescencia en el testículo del paciente #8. Imágenes de TEM en testículos de los pacientes #1, #7 y #8.
Los datos de la TEM mostraron varios monocitos/macrófagos infectados que rodeaban los vasos sanguíneos y migraban hacia el parénquima testicular, lo que sugiere que estas células podrían estar llevando el SARS-CoV-2 al testículo contribuyendo a la infección de las células testiculares. La mayor parte del marcaje de la proteína S se identificó en el interior de los túbulos seminíferos, principalmente en las células germinales, lo que aumenta la preocupación por la posible transmisión sexual, reforzada por la detección del ARN del SRAS-CoV-2 en el semen de los pacientes COVID-19 gravemente enfermos.
El análisis TEM también mostró que el SARS-CoV-2 se replicaba dentro de los macrófagos, expresando ACE2 y la proteasa transmembrana, serina 2 (TMPRSS2), y en las células espermatogoniales. Los complejos de replicación del SARS-CoV-2 eran visibles, con redes de membrana de replicación (RMW) que contenían vesículas de doble membrana (DMV) y el complejo intermedio de retículo endoplásmico de Golgi (ERGIC) que mostraba nuevos viriones. Los resultados sugieren que los monocitos/macrófagos infectados que migran podrían estar transportando el SARS-CoV-2 desde los pulmones a los testículos. Debido a la tolerancia inmunitaria testicular, la eliminación/eliminación del virus en este lugar del cuerpo humano era difícil.
La presencia de linfocitos (CD3+) en los testículos de los pacientes con COVID-19 sugería una infección prolongada. Curiosamente, el SARS-CoV-2 se detectó en los testículos del paciente 1, que falleció 26 días después del inicio de los síntomas, lo que sugiere que los testículos pueden servir de reservorio del SARS-CoV-2, manteniendo los viriones infecciosos durante períodos prolongados.
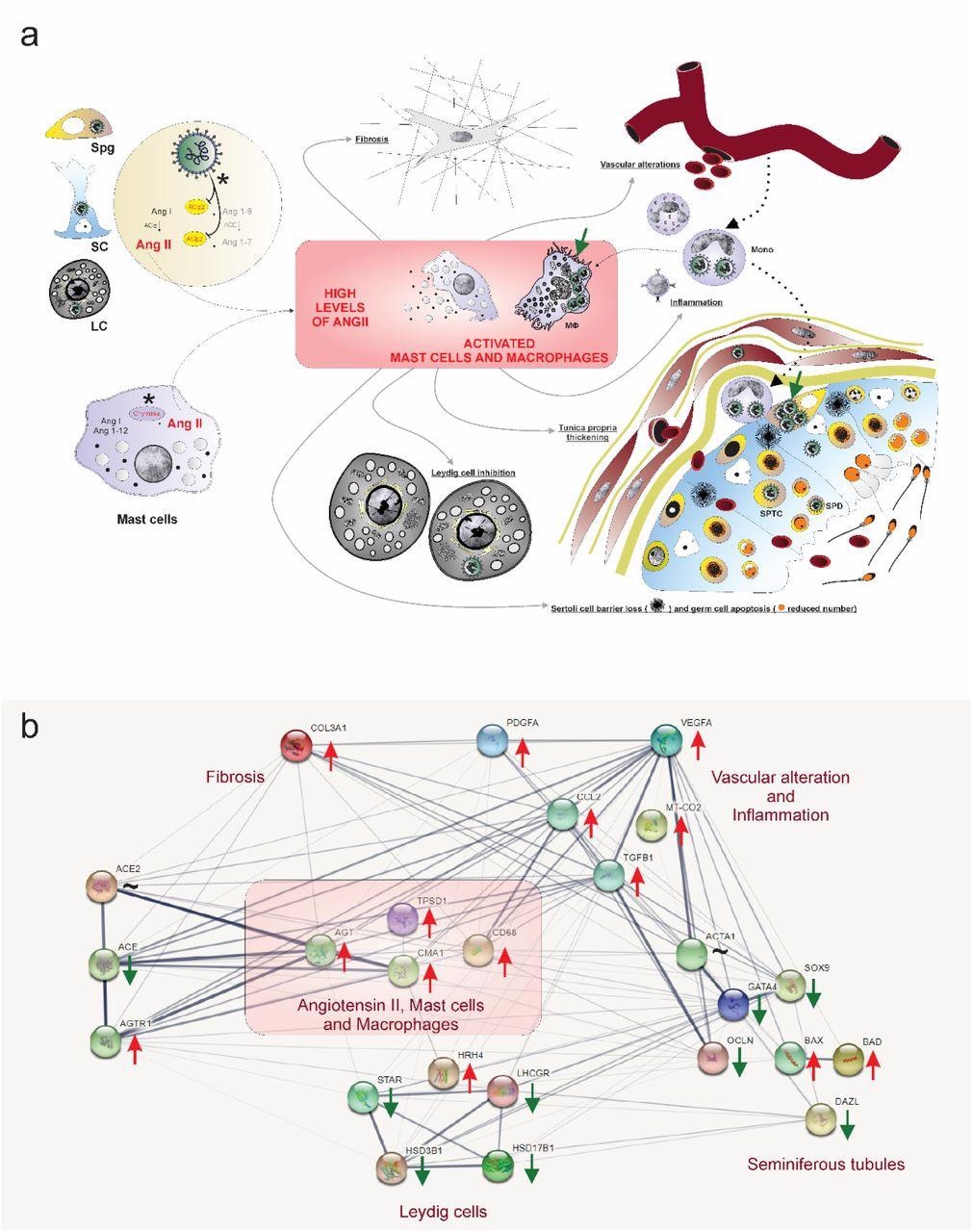
Mecanismos virales y moleculares hipotéticos de la infección y el daño testicular por el SARS-CoV-2. a) El SARS-CoV-2 (color verde) se identificó en las células espermatogonias (Spg), las células de Sertoli (SC), las células de Leydig (LC), los monocitos infiltrantes (Mono), los macrófagos (MΦ), los espermatocitos (sptc) y las espermátidas (sptd). Obsérvense las fábricas virales en los macrófagos y las células espermatogonias (flechas verdes). La influencia directa del SARS-CoV-2 en las células testiculares dificulta la actividad de la ACE2, mientras que la activación de los mastocitos (quimasa positiva) eleva los niveles de angiotensina II (una potente molécula proinflamatoria) (asteriscos). Los factores angiogénicos e inflamatorios pueden inducir la infiltración y la activación de los mastocitos. Los niveles elevados de angiotensina II, la activación de los mastocitos y los factores inflamatorios pueden activar (polarizar) los macrófagos. El fenotipo testicular de los pacientes con COVID-19 (fibrosis, alteración vascular, inflamación, engrosamiento de la túnica propia, pérdida de la barrera de las células de Sertoli, apoptosis de las células germinales e inhibición de las células de Leydig) puede estar relacionado con la elevación de la angiotensina II y la activación de mastocitos y macrófagos. b) Red de genes relacionados con la angiotensina II, los mastocitos activados y los macrófagos (recuadro rosa) extraída de STRING (https://string-db.org/). Estos tres elementos regulan al alza los genes inflamatorios, apoptóticos, fibróticos y vasculares, mientras que regulan a la baja los genes críticos de los túbulos seminíferos y las células de Leydig. Flechas rojas: genes regulados al alza; flechas verdes: genes regulados a la baja; ∼: genes regulados al alza y a la baja según la fase.
Conclusiones
En resumen, los resultados del estudio podrían contribuir a una mejor comprensión del tropismo, la biología y el impacto del SARS-CoV-2 en los testículos y la fertilidad masculina.
La infección por SARS-CoV-2 elevó los niveles de angiotensina II en las células testiculares de los pacientes con COVID-19, lo que activó los mastocitos y los macrófagos. Posteriormente, los testículos de los pacientes con COVID-19 mostraron fibrosis, alteración vascular, inflamación, engrosamiento de la túnica propia, pérdida de la barrera de las células de Sertoli, apoptosis de las células germinales e inhibición de las células de Leydig. Además, los niveles de testosterona intratesticular en los testículos de los pacientes con COVID-19 disminuyeron 30 veces. Además, los péptidos vasoconstrictores fluctuaron en los testículos de los pacientes con COVID-19 en estado crítico.
En conjunto, estos hallazgos sugieren que los testículos no deben descuidarse al evaluar el estado clínico de los pacientes con COVID-19, ya que es un lugar de replicación viral activa y una fuente potencial de carga viral.
*Aviso importante
medRxiv publica informes científicos preliminares que no están revisados por pares y, por lo tanto, no deben considerarse concluyentes, ni guiar la práctica clínica/la conducta relacionada con la salud, ni tratarse como información establecida.