El plasma de ratones jóvenes revierte el envejecimiento de los mayores
 Por Tarun Sai Lomte 22 abr 2024 Revisado por Benedette Cuffari, M.Sc.
Por Tarun Sai Lomte 22 abr 2024 Revisado por Benedette Cuffari, M.Sc.
Un reciente estudio publicado en la revista Nature Aging informa de que las pequeñas vesículas extracelulares (PEV) del plasma de ratones jóvenes contrarrestan el envejecimiento preexistente.

Los investigadores utilizan el análisis de una sola célula para evaluar los efectos del envejecimiento en los óvulos de los ratones
Un nuevo método revierte con éxito la infertilidad masculina en ratones
Estudio: Pequeñas vesículas extracelulares de plasma joven revierten el declive funcional relacionado con la edad mejorando el metabolismo energético mitocondrial. Crédito de la imagen: Ground Picture / Shutterstock.com
¿Puede invertirse el envejecimiento?
Estudios recientes han demostrado que la sangre de ratones jóvenes puede rejuvenecer el cerebro, el hígado, los huesos, el músculo esquelético, el páncreas y el corazón de ratones envejecidos conectando sus sistemas circulatorios mediante parabiosis heterocrónica. Asimismo, las infusiones de plasma pueden recapitular los fenotipos conferidos por el intercambio sanguíneo en la parabiosis heterocrónica.
Los intensos esfuerzos por identificar los factores plasmáticos implicados en la reversión de las alteraciones relacionadas con la edad han conducido al descubrimiento de factores de rejuvenecimiento, projuventud o antienvejecimiento; sin embargo, sus mecanismos de acción siguen sin estar claros.
Sobre el estudio
Las VE son vesículas membranosas de tamaño nanométrico que circulan por el torrente sanguíneo y sirven de mensajeras intercelulares al intercambiar cargas entre las células. En el presente estudio, los investigadores exploraron los efectos rejuvenecedores de las VEs.
Los investigadores purificaron inicialmente los sEV de ratones machos jóvenes y viejos de dos y 20 meses de edad, respectivamente. A continuación, se evaluó la capacidad de las sEV de plasma joven para aumentar la esperanza de vida de los ratones viejos. Los ratones ancianos recibieron un volumen igual de sEVs de plasma joven por vía intravenosa o solución salina tamponada con fosfato (PBS) una vez a la semana hasta su muerte.
Conclusiones del estudio
La administración de sEV a ratones jóvenes aumentó significativamente la puntuación del índice de fragilidad y la mediana de vida útil de los ratones envejecidos en un 12,4%. Además, la edad biológica estimada de los ratones tratados con sEV fue de 15,1 meses, frente a su edad cronológica de 24 meses.
El tratamiento con VEs jóvenes mejoró los niveles de testosterona, el recuento de espermatozoides, la motilidad y la integridad de la cromatina espermática, así como disminuyó la fragmentación del ADN espermático. Se aparearon ratones hembra fértiles con ratones jóvenes o envejecidos, y se examinó visualmente la implantación del embrión 4,5 días después.
El apareamiento con machos jóvenes dio lugar a 7,7 puntos de implantación/hembras preñadas, mientras que los ratones envejecidos no lograron establecer puntos de implantación. No obstante, el tratamiento de ratones envejecidos con VEs jóvenes mejoró significativamente los defectos de fertilidad, con 3,4 sitios/hembra preñada.
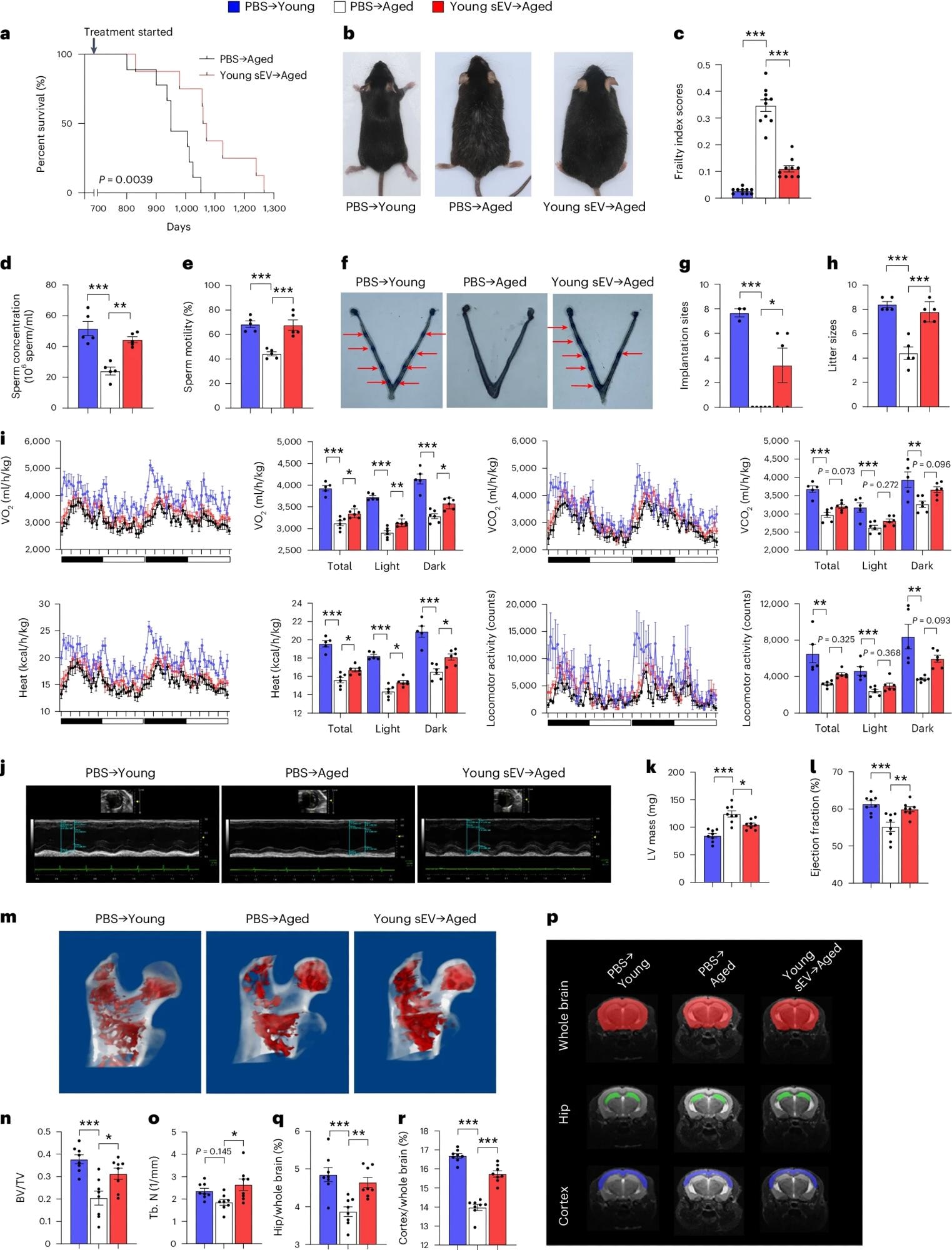 Ratones machos de edad avanzada (20 meses) fueron inyectados por vía intravenosa con 200 μl de PBS o sEVs jóvenes (2 meses) una vez a la semana, y fueron monitorizados para determinar el tiempo de supervivencia o la fisiología de todo el cuerpo. A los ratones machos jóvenes (2 meses) se les inyectó simultáneamente PBS para servir de grupo de control. a, Curvas de supervivencia de Kaplan-Meier en cada grupo (n = 8-9). b , Imágenes representativas de ratones de cada grupo tras 7 meses de tratamiento. c, Puntuación media del índice de fragilidad en cada grupo tras 4 meses de tratamiento (n = 10). d,e, Recuento de espermatozoides y motilidad en cada grupo (n = 5). f,g, Número de puntos de implantación visibles como bandas azules en el útero de ratones hembra apareados con ratones macho de cada grupo. Se muestran imágenes representativas (las flechas rojas indican los lugares de implantación) y datos cuantitativos (n = 3 para PBS → Young; n = 5 para los demás). h, El número de crías engendradas por los ratones macho de cada grupo (n = 5). i, Mediciones por calorimetría indirecta del consumo de O2, la liberación deCO2, la producción de calor y la actividad locomotora en cada grupo (n = 5 para PBS → Young; n = 6 para los demás). j-l, Mediciones ecocardiográficas de las dimensiones cardíacas y los índices de la función cardíaca en cada grupo. Se muestran ecocardiografías en modo M representativas y valores cuantitativos de la masa y la FE del VI (n = 8). m-o, Análisis micro-TC de la microarquitectura trabecular del fémur proximal en cada grupo. Se muestran imágenes 3D representativas del fémur proximal y valores cuantitativos de BV/TV y Tb.N (n = 8). p-r, Análisis morfométricos basados en IRM del hipocampo y el córtex en cada grupo. Se muestra una resonancia magnética representativa de un corte y se calcularon los ratios de volumen (hipocampo/todo el cerebro y corteza/todo el cerebro) (n = 8). La significación se determinó mediante la prueba de rangos logarítmicos en a y mediante ANOVA unidireccional seguida de la prueba de comparaciones múltiples de Dunnett en c-e, g-i, k, l, n , o, q y r. *P < 0,05, P < 0,01 y P < 0,005.
Ratones machos de edad avanzada (20 meses) fueron inyectados por vía intravenosa con 200 μl de PBS o sEVs jóvenes (2 meses) una vez a la semana, y fueron monitorizados para determinar el tiempo de supervivencia o la fisiología de todo el cuerpo. A los ratones machos jóvenes (2 meses) se les inyectó simultáneamente PBS para servir de grupo de control. a, Curvas de supervivencia de Kaplan-Meier en cada grupo (n = 8-9). b , Imágenes representativas de ratones de cada grupo tras 7 meses de tratamiento. c, Puntuación media del índice de fragilidad en cada grupo tras 4 meses de tratamiento (n = 10). d,e, Recuento de espermatozoides y motilidad en cada grupo (n = 5). f,g, Número de puntos de implantación visibles como bandas azules en el útero de ratones hembra apareados con ratones macho de cada grupo. Se muestran imágenes representativas (las flechas rojas indican los lugares de implantación) y datos cuantitativos (n = 3 para PBS → Young; n = 5 para los demás). h, El número de crías engendradas por los ratones macho de cada grupo (n = 5). i, Mediciones por calorimetría indirecta del consumo de O2, la liberación deCO2, la producción de calor y la actividad locomotora en cada grupo (n = 5 para PBS → Young; n = 6 para los demás). j-l, Mediciones ecocardiográficas de las dimensiones cardíacas y los índices de la función cardíaca en cada grupo. Se muestran ecocardiografías en modo M representativas y valores cuantitativos de la masa y la FE del VI (n = 8). m-o, Análisis micro-TC de la microarquitectura trabecular del fémur proximal en cada grupo. Se muestran imágenes 3D representativas del fémur proximal y valores cuantitativos de BV/TV y Tb.N (n = 8). p-r, Análisis morfométricos basados en IRM del hipocampo y el córtex en cada grupo. Se muestra una resonancia magnética representativa de un corte y se calcularon los ratios de volumen (hipocampo/todo el cerebro y corteza/todo el cerebro) (n = 8). La significación se determinó mediante la prueba de rangos logarítmicos en a y mediante ANOVA unidireccional seguida de la prueba de comparaciones múltiples de Dunnett en c-e, g-i, k, l, n , o, q y r. *P < 0,05, P < 0,01 y P < 0,005.
Tras un apareamiento continuado durante un mes, los machos jóvenes y viejos produjeron ocho y cuatro crías/camada, respectivamente. Además, el tratamiento de ratones envejecidos con VEs jóvenes produjo casi tantas crías como los machos jóvenes.
Los ratones ancianos tratados con VES jóvenes también mostraron un mayor consumo de oxígeno y producción de dióxido de carbono que los receptores de PBS, lo que sugiere una restauración parcial de la salud metabólica a los niveles de los ratones jóvenes. El tratamiento también mejoró significativamente los parámetros ecocardiográficos y la arquitectura ósea de los ratones envejecidos. Las imágenes por resonancia magnética (IRM) mostraron atrofia cortical en los ratones envejecidos, que se atenuó con el tratamiento con VES jóvenes.
Los ratones envejecidos mostraron una mayor actividad de la β-galactosidasa asociada a la senescencia (SA-β-gal) en el bazo, riñón, hígado, pulmón, testículo e hipocampo en comparación con los ratones jóvenes. Sin embargo, el tratamiento de ratones envejecidos con VES jóvenes, incluso durante dos semanas, provocó una rápida reducción de los niveles de SA-β-gal en estos órganos.
El tratamiento con IEV jóvenes también restableció los niveles de especies reactivas del oxígeno (ROS) intracelulares en ratones envejecidos a los observados en ratones jóvenes y eliminó la acumulación de un exceso de productos finales de glicación avanzada. Los análisis proteómicos indicaron que las sEV jóvenes podrían revertir los cambios degenerativos asociados a la edad y ejercer efectos rejuvenecedores.
Los investigadores también evaluaron los efectos del tratamiento con VEs aisladas de humanos jóvenes sobre las deficiencias relacionadas con la edad en ratones. Con este fin, el tratamiento de ratones envejecidos con VEs de humanos jóvenes mejoró eficazmente sus déficits cognitivos, aumentó la capacidad de resistencia y favoreció la recuperación de la actividad mitocondrial en el músculo.
Aunque los sEV transportan eficazmente ácidos nucleicos, proteínas y lípidos, la mayoría de los estudios se han centrado en el componente de ácido ribonucleico (ARN) de los sEV, en particular los microARN (miARN). Para dilucidar el papel de determinados miARN en las VEs plasmáticas, se evaluó la expresión diferencial de miARNs en plasma entre ratones jóvenes y envejecidos mediante secuenciación profunda de ARN pequeños.
Experimentos adicionales identificaron cargas de miARN representativas de las VEs jóvenes y envejecidas. Más concretamente, miR-455-3p, miR-144-3p y miR-149-5p representaban el estado joven, mientras que miR-34a-5p, miR-29a-3p y miR-29c-3p representaban el estado envejecido. En particular, el receptor peroxisomal activado por proliferador γ coactivador 1 α (PGC-1α) fue un objetivo común regulado negativamente por miR-34a-5p, miR-29a-3p, y miR-29c-3p.
Además, miR-455-3p, miR-144-3p y miR-149-5p podrían ser estimuladores indirectos de PGC-1α, ya que sus genes diana aguas abajo muestran una correlación inversa con PGC-1α. Los ratones envejecidos mostraron niveles significativamente reducidos de expresión de PGC-1α en el músculo y el hipocampo en comparación con los ratones jóvenes, y el tratamiento con IEV de ratones envejecidos aumentó su expresión.
El silenciamiento de PGC-1α mediante un ARN de pequeña interferencia (ARNsi) disminuyó significativamente los beneficios observados con el tratamiento de las VES jóvenes sobre la respiración mitocondrial. Investigaciones adicionales confirmaron que miR-455-3p, miR-144-3p y miR-149-5p en las VEs jóvenes eran miRNAs rejuvenecedores, mientras que miR-34a-5p, miR-29a-3p y miR-29c-3p en las VEs envejecidas eran miRNAs pro-envejecimiento.
Conclusiones
La administración repetida de IEV jóvenes mejoró la función fisiológica y el rendimiento físico de ratones envejecidos. A corto plazo, el tratamiento con IEV jóvenes mejoró rápidamente todo el organismo. En cambio, el tratamiento con IEV jóvenes revitalizó el rendimiento y las propiedades de los tejidos envejecidos hasta niveles observados en ratones jóvenes durante periodos más largos.
En conjunto, los resultados del estudio indican que las VES jóvenes podrían ofrecer oportunidades prometedoras para rejuvenecer los tejidos envejecidos y mejorar el bienestar y la esperanza de vida.