El tejido testicular congelado durante 20 años es viable
Un estudio innovador publicado en PLoS Biology demuestra que el tejido testicular de rata congelado durante más de 20 años puede trasplantarse con éxito a ratones infértiles para que se regenere y produzca espermatozoides. Sin embargo, los espermatozoides se producen a una tasa reducida en comparación con las muestras de tejido recién congeladas o frescas.
Este método de extracción, congelación y reimplantación de tejido testicular puede ayudar a recuperar la pérdida de fertilidad causada por las terapias contra el cáncer en los niños prepúberes tratados contra el cáncer.
 Criopreservación de tejido testicular
Criopreservación de tejido testicular
El tejido testicular puede congelarse con éxito durante más de 20 años, según un estudio
Este bebé establece un nuevo récord después de nacer de un embrión congelado durante 27 años
Gracias a las mejoras en las terapias contra el cáncer, varios niños sobreviven hasta la edad adulta. Sin embargo, muchos varones pueden sufrir posteriormente una reducción de la fertilidad o infertilidad. El banco de esperma es una opción para los varones pospúberes, pero no para los niños.
En el caso de los niños prepúberes, se puede conservar una biopsia testicular para utilizarla posteriormente. Sin embargo, se carece de tecnologías para hacer uso de estos tejidos testiculares congelados.
El tejido testicular contiene células madre espermatogonias (SSC) que tienen la capacidad de autorrenovarse y diferenciarse en otros tipos de células. Por lo tanto, las SSC son capaces de producir esperma de por vida.
Sin embargo, para la traslación clínica, las SSC tienen que recuperarse de muestras congeladas y trasplantarse a un huésped receptor. En la actualidad, el cultivo de las SSC humanas para producir suficientes células es un reto.
Un estudio realizado en macacos ha demostrado que la reimplantación de trozos de testículo congelados puede generar espermatozoides, en los que el macaco receptor también produjo crías.
La rata como sistema modelo para la espermatogénesis
El proceso de diferenciación de las células germinales masculinas de la rata está bien estudiado. En las ratas, este proceso dura aproximadamente 12 días.
En este estudio se utilizaron células de ratas Sprague-Dawley. Para el aislamiento de las células se utilizó tejido testicular de ratas. Las células se congelaron durante menos de 4 meses (congelación corta) o más de 23 años (congelación larga) en nitrógeno líquido. Los científicos tuvieron acceso a las células ultracongeladas antes de iniciar este estudio. Las SSC se enriquecieron y se trasplantaron a ratones desnudos sin células germinales endógenas. Se prepararon suspensiones celulares a partir de los testículos trasplantados. El transcriptoma de las células se analizó mediante la secuenciación del ARN.
Los donantes eran ratas y los receptores eran ratones. Esto podría ayudar a distinguir entre la espermatogénesis de la rata y la espermatogénesis endógena del ratón, si la hubiera. Las células de rata se identificaron alineando las secuencias con los genomas de referencia de ratón y rata y para cada célula.
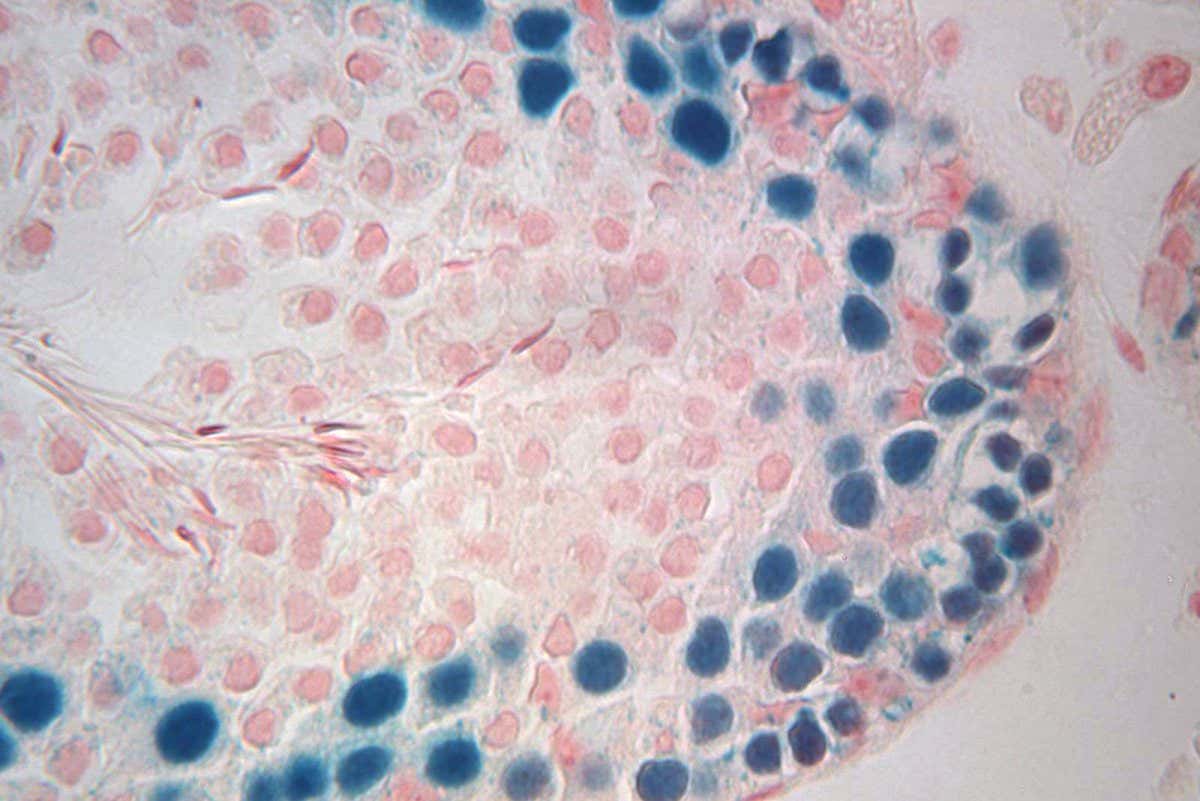
Recolección, congelación y reimplantación de CSE
Este estudio evaluó el potencial de las CSE congeladas para colonizar nichos vacíos en huéspedes receptores y regenerar la formación de esperma. Las CSE de tejidos frescos y congelados produjeron colonias de espermatogénesis.
Sin embargo, las células ultracongeladas produjeron un número significativamente menor de colonias que las células ultracongeladas o frescas. Los trasplantes mostraron todos los tipos de células germinales de rata en diferentes etapas en todos los tratamientos.
La secuenciación del ARN unicelular mostró perfiles de expresión génica similares entre las células descongeladas de corta y larga duración. Los perfiles de expresión génica fueron diferentes para las células frescas. Los cambios de expresión en las células congeladas eran consistentes con el daño celular y el shock por congelación.
Tras el reimplante, las muestras congeladas durante mucho tiempo mostraron un aumento de la señalización de las células madre en el compartimento de las espermatogonias indiferenciadas. El aumento de la señalización de las células madre indica autorrenovación y falta de diferenciación. Las muestras ultracongeladas mostraron menos espermátidas redondas. Esto indica un bloqueo parcial de la espermatogénesis debido a la falta de espermátides alargadas. Así pues, las muestras congeladas durante mucho tiempo no pudieron diferenciarse completamente. Mostraron una población de células madre significativamente enriquecida.
Implicaciones
Este estudio probó la viabilidad de las CSEin situ tras el reimplante. No se basó en la caracterización bioquímica y celular de las células, que puede actuar como sustituto del potencial de las CSE. Esto es importante porque la viabilidad insitu determina el potencial real de las células congeladas.
No existen protocolos para expandir las CSE humanas para su reimplantación. Este estudio establece los antecedentes necesarios para la traslación clínica de esta metodología. Es posible que los protocolos que se desarrollen para las CSE humanas deban tener en cuenta la degradación de la viabilidad en función del tiempo, como se ha demostrado en este estudio.
Este estudio ha demostrado de forma concluyente que la viabilidad se mantiene tras la criopreservación a largo plazo. Esto abre la posibilidad de identificar y abordar los dictadores críticos de la viabilidad.
Este estudio ofrece la posibilidad de mejorar las opciones de fertilidad para los niños prepúberes con cánceres infantiles tratados con éxito.
Conclusiones
Este estudio ha demostrado de forma concluyente que los tejidos testiculares congelados durante más de 23 años pueden reimplantarse con éxito en huéspedes receptores donde pueden regenerarse y producir espermatozoides. Se ha demostrado que la congelación de tejidos durante un tiempo prolongado puede influir en el éxito del reimplante para producir espermatozoides.
Este estudio ha demostrado los efectos de la congelación a largo plazo y advierte que estos efectos deben tenerse en cuenta en futuras consideraciones clínicas.